肺がんの疫学論文を読んでいますと、肺がんになる寄与度も高くて研究期間の長い「喫煙(タバコ)」に関する記載が多く、次いで、根拠の提示を理解しやすい「遺伝子」関連の記載が多いという印象があります。「職業」や「環境」といった原因については、記載の少ない論文が多いように感じます。
今回ご紹介する論文は、2018年の文献です。「喫煙」「遺伝子」「職業」「環境」他、多様な原因に関する内容が網羅的であるため選択させて頂きました。
論文は「Patricia M.de Groot 、Carol C. Wu, Brett W. Carter,et al,The epidemiology of lung cancer,Translational Lung Cancer Res. 2018 Jun; 7(3): 220–233(1)」です。
「Translational」は、狭義の日本語訳は「翻訳の」とか「並進的」という意味ですが、「フレームシフト」、「多職種協同作業」という意味を込める使用も見られ、肺がん研究を複合的に行いたい意向を名取は感じました。
「Translational Lung Cancer Res. 2018 Jun; 7(3): 220–233」を名取が翻訳、選択して引用、他の文献を追加したものが、本文章です。文章の個別箇所の証拠(エビデンス)は、巻末の参照論文番号をご参照ください。
本文章は2020年5月現在の内容であり、2019年以降の変化は反映されていない点、肺がんの疫学論文の全部を網羅していない限界等がある点は、ご理解いただきたいと思います。
2012年、肺がんは、世界で180万人が診断され、同じ年に160万人が死亡したとされます。
パトリシア・M・デ・グルート論文では、「肺がんの発生率と地理的パターンは、男女で異なり」「主にタバコ喫煙の歴史的、文化的、地域的な違いを反映し、肺がんの既知の危険因子には、行動、環境、遺伝的因子があり、個々の患者の応答能力に影響を与えます(2)。」との書き出しの後、肺がんの疫学について、喫煙の概論、教育、所得、肺がん発症年齢、性別、女性の肺がん等を順に記載していますので、次項から一つずつ説明していきます。
疫学とは?
個人ではなく規定された人間の集団を対象として、病気の発生原因や流行状態、予防などを研究する学問です。元々は伝染病を研究対象として始まりましたが、現在では公害や災害など、対象が多様化しています。
1. 肺がんの疫学 喫煙と教育、所得、性別、年齢、女性の肺がんと職業ばく露について
1) 教育・所得
肺がんの発症に最も影響を与える行動がタバコの喫煙である点は、日本でも常識と思います。
一方、日本では、喫煙と学歴、所得の差異に関連があるとの理解は少ないかもしれませんが、以下の論文が知られています。
「喫煙は大卒9.1%で、高卒未満で32.1% と高率です(3)。男性の肺癌は主に喫煙習慣に関連し、タバコの規制のため先進国の男性で発生率が減少しています(4、5)。」喫煙は肺がんの最大の危険因子で、「最大90%が喫煙に起因するとされます(6)。」「喫煙状態に関係なく低い社会経済的地位と肺癌発生率に相関が示されます(7、8)。」
2) 年齢
また、高齢になると、遺伝子の変異の多さ、遺伝子変異を修復する機構の変化、免疫系の変化等が相まって、発がんが起きやすいことが知られています。
「高齢は、DNA損傷、テロメア短縮等の生物学的要因で、がん発症に関連します。」「肺がんと診断される年齢の中央値は、男女70歳で、全体の53%は55-74歳で、37%が75歳以上です。男性肺がん発生率は85-89歳が最も高く10万人中585.9人、女性は75-79歳で最も高く10万人中365.8人です(4)。」肺がんは一般的には、高齢者に起きやすい病気であることがよくわかります。
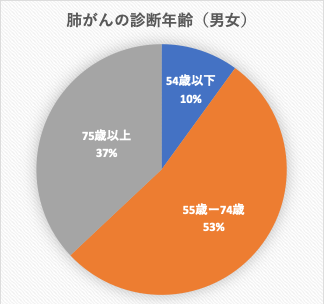
Torre LA, Siegel RL, Jemal A. Lung Cancer Statistics.よりアスベストセンター作成
3) 女性・若年者
次に女性の肺がん、特に遺伝子他の要因の関与について検討しましょう。
「女性の肺がんは先進国で喫煙と関係します。アジアを中心に一部地域では、室内の大気汚染、職業ばく露が女性の肺がんに大きく寄与しています (4)。」
女性の肺がんについて、職業ばく露の指摘がある点は、私たちも注意する必要があります。
職業ばく露とは?
職業として従事した環境の中で、問題となる有害因子(病原微生物(細菌、ウイルス)、薬物、化学物質、アスベスト、物理的要因など)にさらされることを言います。「さらされる」とは、有害因子を吸ったり、食べたり、触れたりしてしまうことです。
女性非喫煙肺がんには、遺伝子素因が一定の役割を果たしています。「女性の非小細胞肺がんでは上皮成長因子受容体(EGFR)突然変異割合が高く、lepidic肺胞上皮置換性増殖の特徴を有す腺がん発生率が高いとされます(9、10)。」「女性喫煙者の遺伝子変異は、CYP1A1遺伝子過剰発現、p53腫瘍抑制遺伝子突然変異等があります(9-11)。女性は喫煙状態を調整後も、肺がん家族リスクが高いとされます(12)。
一方、若年肺がんも知られており、性、組織型、非喫煙、等に特徴があります。「肺がんの10%が55歳未満の患者で、20-46歳の患者の非小細胞肺がんの研究では、若年肺がん患者は女性、組織型は腺がん、非喫煙者、肺がんステージが高い、場合が多いと報告されています(13)。」
次に喫煙と電子タバコについて検討しましょう。
2.喫煙の発がん、電子タバコの有害性
喫煙は肺がんの最大の危険因子ですが、そこまで認知が進むには時間がかかりました。
「喫煙と肺がん発生間には数十年の潜伏期があり、徐々に認知されました(6)。」
喫煙はニコチン依存症とされますが、ニコチン自体は発がん物質ではなく、ニコチン依存を介し肺がんに関与します。「タバコの中毒性成分はニコチンで、神経系のニコチン性アセチルコリン受容体に結合する天然アルカロイドで、エンドルフィン等を含む神経伝達物質の放出を起こします。ニコチンはタバコ依存を促進、肺がんの進行に関連しています(14-16)。」

一方、タバコ喫煙の発がん物質は複合的で、1種類ではなく60種類と複雑です。「タバコの燃焼は最小60の発がん物質を生成、最重要はベンゾ[a]ピレン等多環芳香族炭化水素(PAH)で、発がんのメカニズムは発がん性物質と代謝産物のDNA付加物形成、フリーラジカル損傷(17)で、実験室の研究ではNNKと腺がんとの関係を実証しました(18)。」
次に最近の電子タバコ、電子ニコチン送達システム(ENDS)を説明しておきましょう。
「電子タバコは、流体を加熱する電池コイル、香料、溶媒、液体ニコチンの混合物です。」「2007年に販売されニコチン含有エアロゾルは5分以内に、血清ニコチンレベルをピークに達させます。電子タバコ粒子はホルムアルデヒド、活性酸素等が遠位気管支や肺胞に沈着し炎症性損傷を起こします(19)。」
電子タバコは2007年より販売され、2020年が使用後13年目になります。潜伏期間40年と仮定すると、電子タバコ単独の肺がんの疫学は2050年前後まで判明しないかもしれません。
次に肺がんの、職業や環境要因を検討していきましょう。
3.肺がんの環境リスク要因 ラドン・粒子状物質・調理、そしてアスベスト(石綿)
1) ラドン
日本では稀ですが、欧米ではラドンが肺がん発症に一定の寄与をしており、有名です。
「15世紀ドイツとチェコ国境の鉱山労働者が山岳病と呼ばれ肺扁平上皮癌を発症したことは有名で、肺がんの原因はラドンばく露でした(20、21)。」「ラドンは地殻のウラン崩壊で生成する天然放射性ガスで、アルファ粒子を放出します。ラドンは地下室や低い建物で蓄積、地下職場のラドンは米国で規制されています (21-22)。」
2) 大気中の粒状物質
100年前から指摘されていたのは、大気中物質の肺がんです。
「1920年代、大気中空気は肺がんの潜在的危険因子として認識されました(30)」。「屋外環境における大気発がん性物質は、PAH※1、二酸化硫黄※2、微量金属(23、31)で、これらの長期暴露のある職業で肺がんリスクは上昇します。」「トラック輸送業界における職業ばく露は、肺がんの相対的リスクの最大50%の増加に関連しています(22)。」
粒子状物質の健康障害は、現在呼吸器・循環器疾患等で広く知られていますが、その始まりはどうだったでしょうか?「空気中の特定の物質は工業化とともに増加し、1950年代に規制され始めました(22)。」「1997年米国環境保護庁は、直径2.5μm未満の微粒子に対する法的制限を引き上げました(32)。米国の大規模な都市環境の調査では、粒子状物質のレベルが最も高い米国の六都市で肺癌のリスクが40%増加しました(23)。粒子状物質は、国際がん研究機関(IARC)によってグループI発がん性物質に指定されています。(32)。」
※1 PAH(多環芳香族炭化水素)
有機物の不完全燃焼や熱分解等で生成する化学物質で、発がん性があります。
※2 二酸化硫黄(SO2)
石油や石炭などの化石燃料が燃える際に発生します。気管支炎やぜん息の原因になると言われています。
3) 調理
調理、調理油等の肺がんも指摘されています。「木材、植物材料、固形廃棄物等の化石燃料を加熱・調理に使用した室内大気汚染は、発展途上国の肺がんリスクに関与、アジアの一部地域で非喫煙者の肺がんと関連しています (23、33、34)。以前は十分でなかった調理領域での適切な換気は、肺がんのリスクを50%減少させることができることを示しています (23)。」
4) アスベスト(石綿)
そして、肺がんの職業性ばく露で、過去最大の影響を与えている物質が、石綿(アスベスト)です。この説明は私たちの専門的領域ですので、大幅に説明を追加します。
「発がん性物質への職業ばく露は、肺がんの5-10%と推定されています(23、24-25)。このうちアスベスト(石綿)が最も代表的です。天然の珪酸塩鉱物であるアスベストは、角閃石(アモサイト、クロシドライト、トレノライト)と蛇紋石(クリソタイル)のサブタイプを有し、19世紀から建設にアスベストの使用が続けられています。クリソタイル繊維は胸部悪性腫瘍と最も大きな関連を有します (22)。
アスベストへの職業ばく露は、肺がんの5倍の過剰リスクと相関し(23)、アスベストばく露と喫煙は肺がんリスクに相乗的影響があります (22)。」

ハモンドらより アスベストセンター作成
1800年台後半から産業利用が開始された石綿は、1906年にイギリスのMurray医師が石綿(アスベスト)肺の初めての報告を行い、以後フランス、イタリア、ドイツから報告がなされました(26)。1924年イギリスのCooke氏がアスベスト肺と命名、じん肺の一つとして産業衛生の教科書的疾患となりました。日本の石綿製造業者向け初書籍「石綿 杉山旭著」(昭和9年)でも触れられるほど有名な健康障害でした。
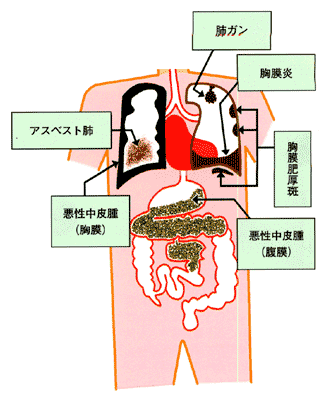
アスベスト(石綿)がおこす主な健康障害 アスベストセンター作成
アスベスト肺がんの報告は1935年からなされ、ドイツでは1940年代から労災補償の対象疾患となり、1947年にMerewetherの剖検例報告が続きました(26)。1955年Dollの疫学的報告でアスベストと肺がんの因果関係は確立しました(27)。アスベスト関連疾患の国際的診断基準はヘルシンキ基準が有名で、1997年基準(28)と2014年に追加改訂された2014年基準(29)があります。
アスベストと肺がんに関しては、本ウェブサイトの「アスベスト(石綿)肺がんとは」もご覧ください。
4.肺がんの遺伝的因子
1) 肺がんは遺伝するのか
ご家族に肺がんのある方の肺がん発症リスクについて、複数の論文の報告があります。「家族歴に肺がんがある場合に肺がん発症リスクは1.7倍に増加(35)、又肺がんリスクは肺がん患者の第一親等で2〜4倍増加し、個人喫煙歴で制御されることを示す(36、37)。」
ご家族に肺がんのある方の肺がん発症リスクが高い理由は、解明されていません。
遺伝的要因の可能性だけではなく、家族同士で似たような生活環境・習慣を共有していることが多いため、それらが複合的に肺がんの原因となっているとも考えられます。
2) 肺がんとゲノム研究
ゲノムとは、遺伝子(gene)と染色体(chromosome)を合わせて造られた言葉で、DNAのすべての遺伝情報のことです。
染色体やゲノム上における、それぞれの遺伝子が占める位置を遺伝子座といいます。
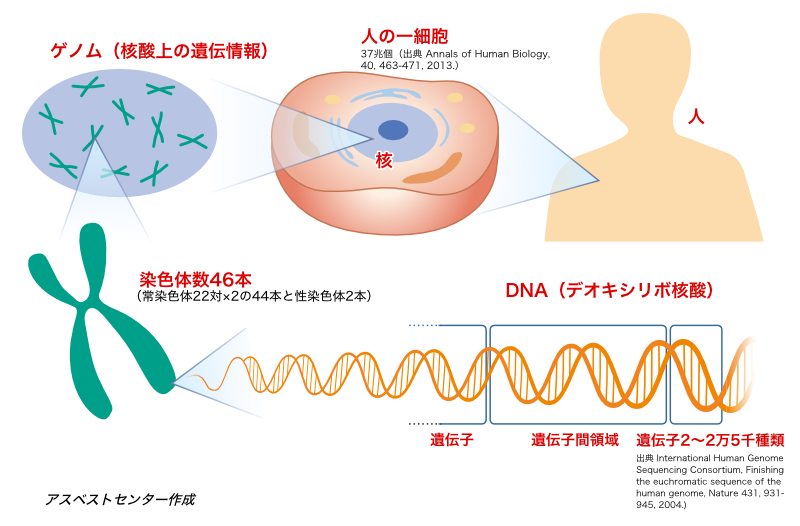
染色体に関する研究は、染色体の部位と肺がんの関係を明らかにし始めています。「ゲノムワイドアソシエーション研究は、肺がんのリスクを増加させる染色体領域として5p15、15q25-26、6q21(ママ)を認識しました(38、39)。5p15は細胞複製関連のテロメラーゼ逆転写酵素を通じ肺腺がんに関連(40)、15q25-26染色体変異は肺がんのニコチン依存性と感受性に関連(41)、遺伝子座6p21はGタンパクシグナル伝達を調節し非喫煙者肺がんに関与します(42)。中国人と日本人の3q28は肺がんリスク増加に関する遺伝子座でした(38)。
さらに特定の遺伝子と肺がんの関係も明らかになりました。「腫瘍は変異を獲得、ほとんどがErbBタンパク質ファミリー(EGFR/HER1-4)、K-ras遺伝子を含む細胞シグナル伝達経路を含みます。他の遺伝的、エピジェネティック変化はp53、p16、PTENPTENの様な腫瘍抑制遺伝子不活性化を引き起こす可能性 があります。EGFR突然変異およびEML4-ALK突然変異は、非喫煙者腺癌と関連しています(39)。」
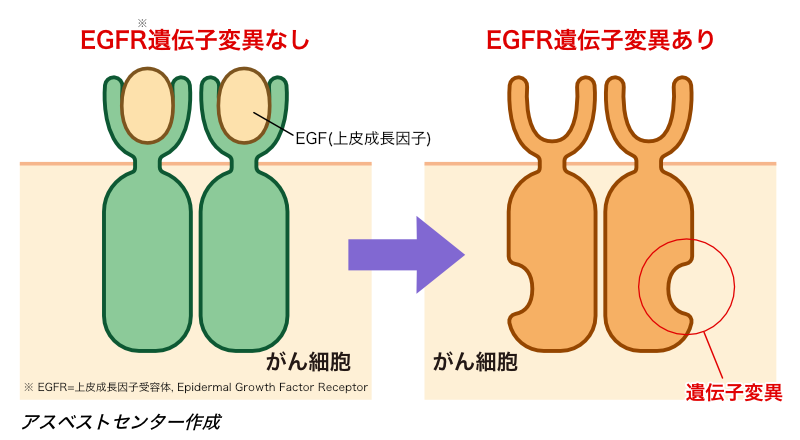
EGFR 遺伝子変異とは?
「EGFR(上皮成長因子受容体)」とは、がん細胞が増殖するためのスイッチのような役割を果たしているタンパク質のことで、がん細胞の表面にたくさん存在しています。
このEGFRを構成している遺伝子の一部(チロシンキナーゼ部位)の変異の中には、がん細胞が増殖するスイッチを常にオンにして、がん細胞が増殖するのに必要な信号を細胞内に伝え続けるものもあります。
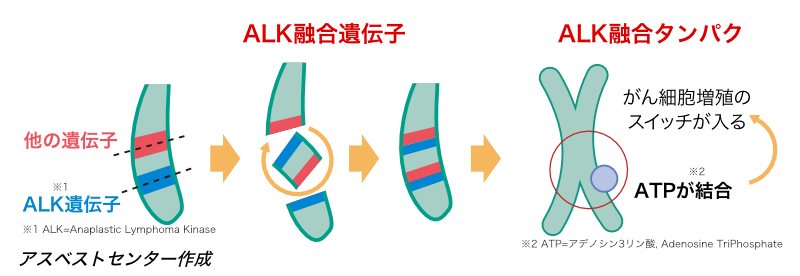
EML4-ALK突然変異とは?
「ALK遺伝子」は細胞の増殖を促す働きがあり、「増殖スイッチ」のオン・オフは通常はうまく制御されています。しかし、なんらかの原因で「ALK 遺伝子」と他の遺伝子が融合し、特殊な遺伝子(ALK 融合遺伝子)ができてしまうと、この遺伝子からできるタンパク質(ALK融合タンパク)の作用により、がん細胞を増殖させるスイッチが常にオンとなり、がん細胞が限りなく増殖してしまいます。
EML4-ALK融合遺伝子とはALK遺伝子とEML4遺伝子が融合するという突然変異を起こした発がん遺伝子のことで、EML4-ALK遺伝子に異常のある肺がんは、腺癌の約5%にみられ、若年、非喫煙者の患者に多く、やや女性に多いことが特徴です。
5.非喫煙者の肺がん(Lung cancer in never smokers=LCINS)
非喫煙者の肺がんが現在注目を集めており、環境、職業、大気、遺伝子、性が検討されています。「非喫煙者の肺がんは現在、がん死の第7の原因」で(13)、「世界で肺がん患者の25%が非喫煙者と推定され」ます(43)。
非喫煙者肺がんは、「主に女性および若い患者に発生、細胞型は腺癌、EGFR突然変異やEML4-ALK変異があり、免疫標的療法に良好に反応します(39、43、44)」。「女性非喫煙者肺がんの割合は東・南アジアで高く、女性の60-80%は非喫煙者です(33、34、45)。」「環境リスク要因は、副流煙の喫煙ばく露、環境粒子状物質、職業ばく露、室内大気汚染、ラドン(32、46)で、非喫煙者肺がんで主要な役割を果たすとされます。」

(上記文章は、2020年5月時点の内容です。)
肺がんと診断された時、アスベストについて考えましたか?
あなたやあなたの大切な方が、原発性肺がんと診断されたとき、病院の医師から喫煙歴を問診されたと思いますが、アスベストに関することは尋ねられたでしょうか?
また、ご自身やご家族で、過去の石綿(アスベスト)との接点を考えられたでしょうか?
今、多くの「アスベスト(石綿)肺がん」の患者さんたちが、見逃されています。
参考文献
- M. de Groot1, Carol C. Wu,1 Brett W. Carter,1 et al,The epidemiology of lung cancer,Transl Lung Cancer Res. 2018 Jun; 7(3): 220–233
- J, Soerjomataram Iet al. GLOBOCAN 2012 v1.0, Cancer Incidence and Mortality Worldwide: IARC Cancer Base No. 11 [Internet]. Lyon, France: International Agency for Research on Cancer, 2013.
- Siegel RL, Miller KD, Jemal A. Cancer statistics, 2018. CA Cancer J Clin 2018;68:7-30.
- Torre LA, Siegel RL, Jemal A. Lung Cancer Statistics. Adv Exp Med Biol 2016;893:1-19.
- Youlden DR, Cramb SM, Baade PD. The International Epidemiology of Lung Cancer: geographical distribution and secular trends. J Thorac Oncol 2008;3:819-31.
- Doll R. Evolution of knowledge of the smoking epidemic. In: Boyle P et al. editors. Tobacco: Science, policy and public health. 2nd ed. New York, NY: Oxford University Press, 2010:1-12.
- Dalton SO, Frederiksen BL, Jacobsen E, et al. Socioeconomic position, stage of lung cancer and time between referral and diagnosis in Denmark, 2001-2008. Br J Cancer 2011;105:1042-8.
- Sidorchuk A, et al. Socioeconomic differences in lung cancer incidence: a systematic review and meta-analysis. Cancer Causes Control 2009;20:459-71.
- Kligerman S, White C. Epidemiology of lung cancer in women: risk factors, survival, and screening. AJR Am J Roentgenol 2011;196:287-95.
- Patel JD. Lung cancer in women. J Clin Oncol 2005; 23:3212-8.
- Planchard Det al. Differential expression of biomarkers in men and women. Semin Oncol 2009;36:553-65.
- North CM et al, Women and lung cancer: what is new? Semin Thorac Cardiovasc Surg 2013; 25:87-94.
- Arnold BN et al. Lung Cancer in the Very Young: Treatment and Survival in the National Cancer Data Base. J Thorac Oncol 2016; 11:1121-31.
- Benowitz NL. Clinical pharmacology of nicotine: implications for understanding, preventing, and treating tobacco addiction. Clin Pharmacol Ther 2008;83:531-41.
- Saccone SFet al. Cholinergic nicotinic receptor genes implicated in a nicotine dependence association study targeting 348 candidate genes with 3713 SNPs. Hum Mol Genet 2007; 16:36-49.
- Costa F, Soares R. Nicotine: a pro-angiogenic factor. Life Sci 2009;84:785-90.
- Hecht SS. Tobacco carcinogenesis: mechanisms and biomarkers. In: Boyle P et al. editors. Tobacco: Science, policy and public health. New York, NY: Oxford University Press, 2010:127-54.
- Hecht SS. It is time to regulate carcinogenic tobacco-specific nitrosamines in cigarette tobacco. Cancer Prev Res (Phila) 2014;7: 639-47.
- Dinakar C, O'Connor GT. The Health Effects of Electronic Cigarettes. N Engl J Med 2016;375:2608-9.
- Samet JM. Diseases of uranium miners and other underground miners exposed to radon. Occup Med 1991; 6:629-39.
- Krewski D et al. Residential radon and risk of lung cancer: a combined analysis of 7 North American case-control studies. Epidemiology 2005; 16:137-45.
- Dela Cruz CS et al. Lung Cancer: Epidemiology and Carcinogenesis. In: Shields TW, editor. General Thoracic Surgery.7th ed. Philadelphia: Wolters Kluwer Health/Lippincott Williams & Wilkins, 2009:1281-98.
- Alberg AJet al.Epidemiology of lung cancer: Diagnosis and management of lung cancer, 3rd ed:American College of Chest Physicians evidence-based clinical practice guidelines. Chest 2013;143: e1S-29S.
- Doll R, Peto R. The causes of cancer: quantitative estimates of avoidable risks of cancer in the United States today. J Natl Cancer Inst 1981;66:1191-308.
- Consonni et al. Lung cancer and occupation in a population-based case-control study. Am J Epidemiol 2010; 171:323-33.
- from lung cancer in asbestos workers,Br.J.Ind Med.12:81-86
- A. Asbestos, asbestosis, and cancer: the Helsinki criteria for diagnosis and attribution. Scand. J. Work Environ. Health, 23(4), 311-316.
- Tylecote F. Cancer of the Lung. Lancet 1927; 2:256-7.
- Alberg AJ, Yung RC, Strickland P, et al. Respiratory cancer and exposure to arsenic, chromium, nickel and polycyclic aromatic hydrocarbons. Clin Occup Environ Med 2002;2:779-801.
- Pope CA, 3rd, Burnett RT, Thun MJ, et al. Lung cancer, cardiopulmonary mortality, and long-term exposure to fine particulate air pollution. JAMA 2002;287:1132-41.
- Hamra GB, Guha N, Cohen A, et al. Outdoor particulate matter exposure and lung cancer: a systematic review and meta-analysis. Environ Health Perspect 2014;122:906-11.
- Torok S, Hegedus B, Laszlo V, et al. Lung cancer in never smokers. Future Oncol 2011;7:1195-211.
- Lissowska J, Foretova L, Dabek J, et al. Family history and lung cancer risk: international multicentre case-control study in Eastern and Central Europe and meta-analyses. Cancer Causes Control 2010;21:1091-104.
- Coté ML, Kardia SL, Wenzlaff AS, et al. Risk of lung cancer among white and black relatives of individuals with early-onset lung cancer. JAMA 2005;293 :3036-42.
- Schwartz AG, Ruckdeschel JC. Familial lung cancer: genetic susceptibility and relationship to chronic obstructive pulmonary disease. Am J Respir Crit Care Med 2006;173:16-22.
- Schwartz AG, Cote ML. Epidemiology of Lung Cancer. Adv Exp Med Biol 2016;893:21-41.
- Herbst RS, Heymach JV, Lippman SM. Lung cancer. N Engl J Med 2008;359:1367-80.
- Landi MT et al. A genome-wide association study of lung cancer identifies a region of chromosome 5p15 associated with risk for adenocarcinoma. Am J Hum Genet 2009 ;85:679-91.
- Thorgeirsson TE et al. A variant associated with nicotine dependence, lung cancer and peripheral arterial disease.
- Yokota J, Shiraishi K, Kohno T. Genetic basis for susceptibility to lung cancer: Recent progress and future directions. Adv Cancer Res 2010;109:51-72.
- Okazaki I, Ishikawa S, Ando Wet al. Lung Adenocarcinoma in Never Smokers: Problems of Primary Prevention from Aspects of Susceptible Genes and Carcinogens. Anticancer Res 2016;36:6207-24.
- Wakelee HA, Chang ET, et al. Lung cancer incidence in never smokers. J Clin Oncol 2007;25:472-8.
- Sun S, Schiller JH, AF. Lung cancer in never smokers-a different disease. Nat Rev Cancer 2007;7:778-90. 90
- Rivera GA, Wakelee H. et al Cancer in Never Smokers. Adv Exp Med Biol 2016;893:43-57.
(この文は2020年5月の内容です。2019年以降の変化、肺がん疫学の全要因を反映していない点ご了承ください。)
